近日,礼来宣布其Nectin-4靶向ADC药物LY4052031因安全性问题暂停临床试验。
Nectin-4是ADC药物开发的一个热门靶点,目前全球仅一款Nectin-4靶向ADC产品被批准上市,即Padcev,获批用于治疗尿路上皮癌。礼来曾布局两款下一代抗Nectin-4 ADC药物:LY4052031(毒素为DNA拓扑酶I抑制剂camp98)和LY4101174(毒素为exatecan)。此次暂停涉及LY4052031,而LY4101174仍然在进行临床I期试验,人体药效及毒性反应有待观察。
此次事件也引发行业对Nectin-4 ADC安全性的关注,并将ADC药物的研发难点暴露无遗:载荷毒性控制、连接子稳定性,任何一个环节的“短板”都可能引发连锁反应。
1.中国Biotech迎来机会
Nectin-4是一种免疫球蛋白样抗原,正常组织仅表达低至中等水平的Nectin-4,但在多种癌症中过表达,包括尿路上皮癌、乳腺癌、卵巢癌、非小细胞肺癌和胃癌等。同时,在回顾性研究中,Nectin-4的高表达与较差的预后有关,这也意味着它可以用作改善患者预后。这使得该蛋白成为癌症治疗的一个有吸引力的靶点。
目前,全球仅一款Nectin-4 ADC获批上市,即安斯泰来和辉瑞的enfortumab vedotin(维恩妥尤单抗Padcev)。该药于2019年在美国首次获批,用于二线治疗晚期尿路上皮癌;2023年又获批与Keytruda的联合用于一线治疗局部晚期或转移性尿路上皮癌患者。
Padcev销售额在2023年就突破了10亿美元,2024年销售额达到15.88亿美金,同比增长超过50%。根据Nature Reviews的预测,到2026年,Padcev的销售额有望达到35亿美元。
Padcev在尿路上皮癌上的成功证明了Nectin-4靶点ADC的临床应用价值。
但Padcev来自Seagen的第二代抗体偶联技术,存在偶联比的不均一等限制,这会带来药物的异质性。其说明书上带有可导致重度和致死性皮肤不良反应的黑框警告,包括Stevens-Johnson综合征(SJS)和中毒性表皮坏死松解症(TEN),该类皮肤不良反应主要发生在治疗的第一周期,但也可能较晚发生。此外Padcev在除尿路上皮癌的其它癌种上疗效有限,限制了其临床适应症的应用范围。
因此,各企业试图从毒素、连接子方面进行优化,开发新一代Nectin-4 ADC药物,并拓展其临床应用范围。
其中,迈威生物的9MW2821进展最快,已进入临床Ⅲ期。
9MW2821应用了其ADC开发平台的含药连接子及定点偶联技术两项全球专利,采用半胱氨酸桥定点偶联,形成DAR值均一为4的ADC药物,同时使用定点连接子接头IDconnect替换了马来酰亚胺(MC),使得稳定性更好。相对Padcev,9MW2821在Nectin-4靶向治疗常见的皮肤毒性,眼毒性以及周围神经病变均有较大的改善。
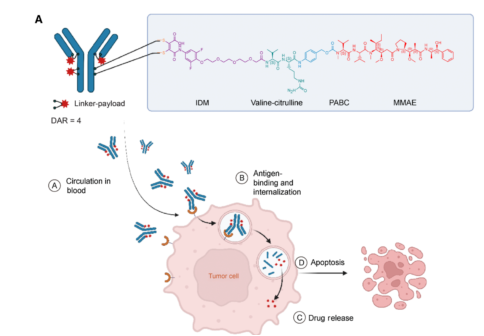
图片来源:迈威生物
目前,9MW2821针对尿路上皮癌(UC)、三阴性乳腺癌(TNBC)、食管癌(EC)、宫颈癌(CC)等多个适应症显示出优异的有效性和良好的安全性。
表1 II期临床9MW2821 1.25mg/kg剂量组下的临床研究成果
(截至2024年6月5日)




